Oswald Auguste de Bruin
Georen te Utrecht
RECHERCHES SYNTHÉTIQUES DANS LE DOMAINE DES AUXINES
INTRODUCTION
Les
expériences de Went en 1927 ont attiré l'attention sur le fait que dans le
processus de l'extension cellulaire des végétaux supérieurs certaines
substances chimiques jouent un rôle particulier. On a pu constater, au moyen du
test d'avoine, par des expériences de diffusion, qu'une matière au poids
moléculaire relativement bas règle l'extension cellulaire dans la jeune plante
d'avoine. La vitesse de diffusion de cette substance dans l'agar-agar indiquait
un poids moléculaire entre 300 et 400. Le test d'avoine donnait des résultats
reproductibles de sorte qu'on put également étudier le côté chimique du
problème. L'hormone de croissance des végétaux supérieurs, à laquelle Kögl donna
plus tard le nom d'auxine, ne se présente en général dans les végétaux qu'en
concentrations très restreintes. Lorsque Kögl et Haagen-Smit eurent trouvé dans
l'urine de l'homme des quantités relativement grandes de cette hormone, ils
purent, en 1931, isoler de l'auxine sous forme cristalline.
Plus tard on
parvint aussi à isoler cette substance de croissance en partant de matières
végétales (malt et huile de maïs), tandis qu'on trouva en outre une seconde
substance active de caractère analogue, et pour faire la distinction on nomma
ces deux hormones « auxine-a » et « auxine-b »
Une analyse
élémentaire et une détermination du poids moléculaire de l'auxine-a donnèrent
la formule brute C18H32O5. Peu après on put constater que cette substance
contenait un groupement carboxylique, ainsi que trois groupements d'hydroxyle
alcoolique. Un de ces hydroxyles doit se trouver en position 8 par rapport au
groupement carboxylique, car il se présente une mutarotation qui se stabilise
rapidement. De la façon dont s'effectue l'hydrogénation catalytique il s'ensuit
que la molécule doit contenir une double liaison, tandis que l'analyse de la
dihydroauxine-a permet de calculer la présence d'un cycle carboné.
Après
l'oxydation de l'auxine-a au moyen d'une solution de permanganate alcaline il
se forma un acide dicarboxylique (C13O4) à activité optique. La dégradation et
la synthèse prouvèrent que cet acide était l'acide a,a'-bis(1'-méthylpropyl)-glutarique.

L'oxydation de la dihydroauxine-a
par le trioxyde de chrome donna une cétone cyclique dont la formule de
constitution est la suivante (II):

Les
résultats de ces deux dégradations oxydatives des auxines -a et -b démontraient
clairement que la double liaison doit se trouver dans un cycle pentagonal,
tandis que les cinq atomes de carbone qui restent doivent être fixés au cycle
pentagonal à l'emplacement du groupement carbonyle.
Jusqu'ici
nous n'avons prêté attention qu'à l'auxine-a, puisque, comme il a été prouvé
plus tard, l'auxine-b peut être obtenue de l'auxine-a par déshydratation. La
dihydroauxine-b de même que la dihydroauxine-a donne, après oxydation par
l'oxyde de chrome, la cétone II, de sorte que la constitution des auxines ne
diffère que dans la structure de la chaîne latérale. En chauffant l'auxine-b
au-dessus du point de fusion on a pu constater l'élimination d'une molécule
CO2, ce qui a permis de conclure que le groupement carbonyle, dont l'analyse a
prouvé la présence, doit se trouver en position b par rapport au groupement carboxylique. Les premières réactions
avec le chlorure ferrique ont échoué. Plus tard on a pu, après exposition aux
rayons ultra-violets dans une cuvette en quartz, constater réellement une
coloration rougeâtre. Par conséquent on put fixer pour l'auxine-b la formule de
constitution suivante (III) :

En partant
des produits de réaction obtenus après l'oxydation de l'auxine-a par le
tétracètate de plomb on a pu démontrer la présence d'acide glyoxylique et d'un
oxy-aldéhyde avec seize atomes de carbone. Ceci prouvait donc que les atomes de
carbone ayant une position a et b par rapport au groupement carboxylique
portent chacun un hydroxyle, d'où il s'ensuit qu'une scission oxydative des
alpha-glycols peut se produire. Pour l'auxine-a, Kögl fixa la formule suivante
(IV) :

Maintenant le passage de
l'auxine-a à 1’auxine-b peut être formulé de façon distincte:

Dès les premières tentatives
d'isoler l'auxine on s'aperçut que la teneur en substances de croissance d'un
concentrât diminuait beaucoup avec le temps. On trouva aussi que les cristaux
de l'auxine-a et -b et leurs lactones avaient perdu complètement leur activité
au bout de quelques mois. Ni le vide poussé, ni l'exclusion de la lumière, ni
une température basse ne pouvaient entraver ce processus. Les cristaux devenus
inactifs ne se distinguaient des préparations actives ni par leur aspect, ni
par leur formule brute. Le point de fusion et la rotation au contraire
s'étaient modifiés.
En partant
d'une préparation d'auxine-a devenue inactive on a pu isoler par
cristallisation deux substances nouvelles dont la rotation différait, mais dont
la formule brute était égale à celle de l'auxine-a. Dans la pseudo-auxine-a1 et
-a2, comme on a nommé ces isomères de l'auxine-a, la double liaison (coloration
jaune avec le tétranitrométhane) et le groupement carboxylique libre (réaction
au tournesol) étaient encore présents. Toutefois on ne constata plus de
mutarotation.
On ne put se
rendre exactement compte de cette propriété caractéristique de l'auxine-a que
lorsque Kögl, Konings-berger et Erx1eben) réussirent à isoler, après oxydation
de la pseudo-auxine-a1 par l'ozone, une cyclopentanolone (V) sous forme de
phénylhydrazone.
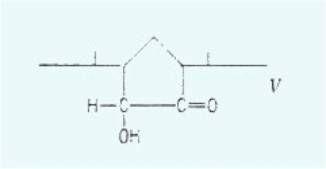
La formation de cette acyloïne ne
peut être expliquée qu'en admettant qu'il se produit une transposition
allylique pendant l'inactivation.

Donc l'hydroxyle
d subit une migration au carbone z, tandis que la double liaison devient
semi-cyclique.
Ceci
explique la formation de deux isomères physiologiquement inactifs, et en même
temps le fait que ceux-ci ne présentent plus le phénomène de mutarotation.
On se heurta à des difficultés plus grandes en cherchant à expliquer
l'inactivation de la lactone de l'auxine-a (VIII).
Ce
changement ne peut pas s'expliquer par une simple transposition allylique, car
le corps qu'on obtient garde le caractère d'une lactone. Toutefois les analyses
élémentaires démontrent que, pendant la réaction, une molécule d'eau a été
éliminée. Durant le processus de l'inactivation il s'est formé une seconde
double liaison, car deux molécules d'hydrogène ont été fixées pendant l'hydrogénation
catalytique. La déshydratation doit avoir eu lieu aux atomes de carbone a, b ou g,
puisque le groupement d-hydroxylique est
fixé par la structure de la lactone. La dégradation du produit inactif a
toutefois montré que des modifications autres que la déshydratation doivent
avoir eu lieu, car dans la dégradation par l'ozone la cétone cyclique C13H24O
(II) que nous avons déjà mentionnée s'était formée. La position de la double
liaison qui se trouvait à l'origine dans le cycle, doit donc s'être modifiée en
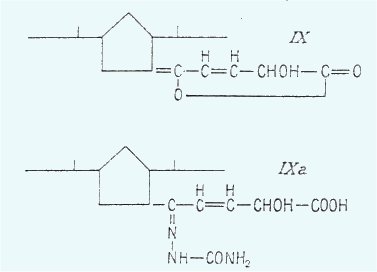
passant à une double liaison semi-cyclique. En outre on a pu préparer une
semi-carbazone (IX a) avec la formule brute C19H33O4N3 acide au tournesol. Se
basant sur ces données Koningsberger établit la formule provisoire IX pour la
lactone de l'auxine-a inactivée et la formule IXa pour la semicarbazone.
L'étude du
spectre ultra-violet dévoila le caractère étrange de la lactone de l'auxine-a.
Il n'y a aucune raison, quand il s'agit d'un composé ne contenant pas de
système chromophore comme la lactone de l'auxine-a, pour s'attendre à une bande
d'absorption dont le sommet bien marqué corresponde .à 295 mm. comme il a été déterminé. L'auxine-a,
acide libre, ne présente pas d'absorption spécifique entre 240 et 400 mm. La lactone de l'auxine-a et le produit qui
en résulte par l'auto-inactivation ont un spectre absolument identique. Aussi
a-t-on remarqué que la lactone de l'auxine-a perd son activité par l'exposition
aux rayons ultra-violets, et qu'elle se transforme en un composé identique à
celui qui se forme par l'auto-inactivation. Ceci prouve que l'exposition aux
rayons ultra-violets accélère beaucoup la modification, qui sans cela s'opère
spontanément dans la molécule. Kögl a proposé de nommer cette préparation
« lumi-auxone".
Il y avait
une opposition apparente entre l'inactivation rapide de la lactone de
l'auxine-a par les rayons ultra-violets et la stabilité de l'auxine-a dans les
mêmes circonstances, parce que la mutarotation indique un équilibre entre ces
deux composés. Cette difficulté a été annulée par les expériences de Kög1 et
Schuringa. Pour étudier l'équilibre entre l'acide et la lactone on emploie la
rotation spécifique. La mesure se fait avec une concentration plusieurs fois
plus grande que celle qu'on emploie pour la mesure des spectres ultra-violets.
Kögl et Schuringa ont supposé que la concentration des ions hydrogène pouvait
jouer un rôle, et en effet une solution très diluée d'auxine-a au pH 4,3
exposée aux rayons ultra-violets se transformait en lumi-auxone.
Les mesures
des courbes d'absorption ultra-violette de la lumi-auxone furent cause qu'on se
mit à douter sérieusement de la formule IX. Cette formule, en effet, était
basée sur les données obtenues de la dégradation par l'ozone. Mais ces données
ne procurent d'indications que sur l'emplacement de la double liaison.
Bo1dingh, vues la courbe d'absorption ultra-violette et la dégradation, examina
les possibilités de constitution de la lumi-auxone, au moyen de composés
semblables. Finalement il propose de formuler la lumi-auxone comme a-pyrone substituée au carbone six, Quoiqu'il
faille une série de transpositions pour en expliquer la formation à partir de
l'auxine-a.
Nous
donnons, ci-dessous la courbe d'absorption du 6-cyclopentyl-a-pyrone (XI) et de la lumi-auxone, ainsi que
la formule XI et celle de la lumi-auxone sous la forme proposée par Bo1dingh
(X).

Bien des
raisons portaient à supposer que le test d'avoine devait être spécifique pour
des composés ayant une constitution semblable à celle de l'auxine-a et -b. Tout
d'abord l'auto-inactivation caractéristique; ensuite le fait que de légères
modifications apportées à la molécule, comme l'hydrogénation de la double
liaison.

l'estérification
et l'acétalisation du carboxyle, font disparaître complètement l'activité. Il a
fallu abandonner ce point de vue quand Kögl et ses collaborateurs eurent isolé
de l'urine et du malt une troisième substance de croissance très active qui
s'avéra identique à l'acide indole-3-acétique déjà connu (XII

Ce dérivé de 1’indole. par sa
synthèse facile, invitait à étudier les rapports entre la constitution de sa
molécule et son activité physiologique. Kögl et Kostermans trouvèrent que pour
les dérivés de l'indole la distance entre le groupement carboxylique et le
noyau pyrrolique joue un rôle important.
Nous ne
donnerons ici que quelques points principaux qui font entrevoir l'essor qu'a
pris par la suite l'étude des substances de croissance des végétaux supérieurs,
entamée par Kög1 et ses collaborateurs. Quand on eut pris connaissance de
l'action biologique d'une substance simple comme l'acide indole-3-acétique, le
problème des substances de croissance prit une grande importance pratique. On
développa des tests plus simples et on trouva que les valeurs obtenues selon
des méthodes différentes ne pouvaient pas toujours être comparées. On trouva
aussi que la substance de croissance, par une trop grande concentration, peut
inhiber le développement des plantes.
On
synthétisa de nombreux composés dont certains étaient actifs et d'autres
inactifs dans les tests. Ces nouvelles données sur l'activité permirent à
Veldstra de développer une théorie sur le rapport entre l'activité
physiologique et la constitution chimique.
Nous
terminons cette introduction en faisant remarquer que les recherches sur les
substances de croissance, entreprises dans un but uniquement scientifique, ont
pris au bout de quelques années une importance très grande pour l'agriculture
et l'horticulture. Des quantités considérables de ces substances de croissance
synthétiques sont appliquées entre autres pour le désherbage, pour éviter la
chute prématurée des pommes, et pour favoriser l'enracinement des boutures.
RÉSUMÉ
Au
Laboratoire de Chimie Organique de l'Université d'Utrecht. après avoir isolé
des auxines. on a étudié les possibilités de synthétiser ces corps.
Le présent
travail envisageait en particulier la synthèse de composés qui, en ce qui
concerne la constellation des groupements fonctionnels, peuvent être des
substances-modèles de l'auxine-a. de l'auxine-b ou de leurs lactones.
En premier
lieu on traite les propriétés d'un composé ayant. comme l'auxine un groupement
d'alcool allylique. D'après des expériences antérieures, exécutées dans notre
laboratoire, on admettait que ce composé devait subir une transposition
allylique spontanée. celle qui donne lieu à l'auto-inactivation de l'auxine. De
nouvelles recherches démontrent que la substance-modèle dans un milieu privé
d'oxygène ne se modifie pas.
En second
lieu, on indique une méthode générale pour synthétiser les lactones des acides b-céto-g-oxy-carboniques
par la réaction de Reformatsky.
Ensuite on
décrit la préparation d'une série de composés montrant une certaine analogie
structurelle avec les auxines. La constitution de ces composés est déduite de
la préparation et des données analytiques. Les formules de constitution en
question sont encore vérifiées par les conclusions des spectres d'absorption
dans l'ultra-violet.
II faut
mentionner particulièrement la préparation de la lactone de l'acide d-(cyclopentényl-1)-d-oxy-b-céto-pentanoïque.
Quant à la constitution ce composé ne diffère de la lactone de l'auxine-b que
par l'absence des deux groupements butyliques secondaires du cycle penténique.
Ceci indique la voie qui peut conduire à une synthèse totale de la lactone de
l'auxine-b.
Le test
d'avoine n'indique aucune activité de ces nouveaux corps. Dans la seconde partie de cette thèse on
traite un nouvel isolement de biotine en partant du jaune d’œuf. Les cristaux
obtenues se manifestent identiques au produit isolé du foie et du lait par les
auteurs américains. Autrefois la dégradation de la biotine du jaune d’œuf a
donné naissance à un composé inconnu à ce moment, l’acide a-isopropyl-b-sulfopropionique, dont la constitution a été confirmée par une
synthèse. La formule de constitution de la biotine, prouvée depuis
irréfutablement par les auteurs américains, ne peut pas expliquer la formation
de l’acide a-isopropyl-b-sulfopropionique. Il y a discussion des causes possibles de ce
désaccord.
Mots clefs : absorption / acide / activité / allylique /
analyse / auxine / avoine / biotine / cétone / composé / constitution / croissance /
dégradation / déshydratation / dihydroauxine / expérience / formation / formule /
groupement / hormone / hydrogénation / hydroxyle / inactivation / indole / isomère /
kögl / lactone / lumi-auxone / molécule / mutarotation / ozone / plante / préparation /
processus / réaction / recherche / synthèse / végétal / bruin